2018년 3월 6일, 어제 FDA가 23andMe의 BRCA 1/2 유전자의 DTC 테스트를 승인했습니다. 미국에서 암 스크리닝을 위한 DTC 서비스로는 최초이자 유일한 테스트입니다.
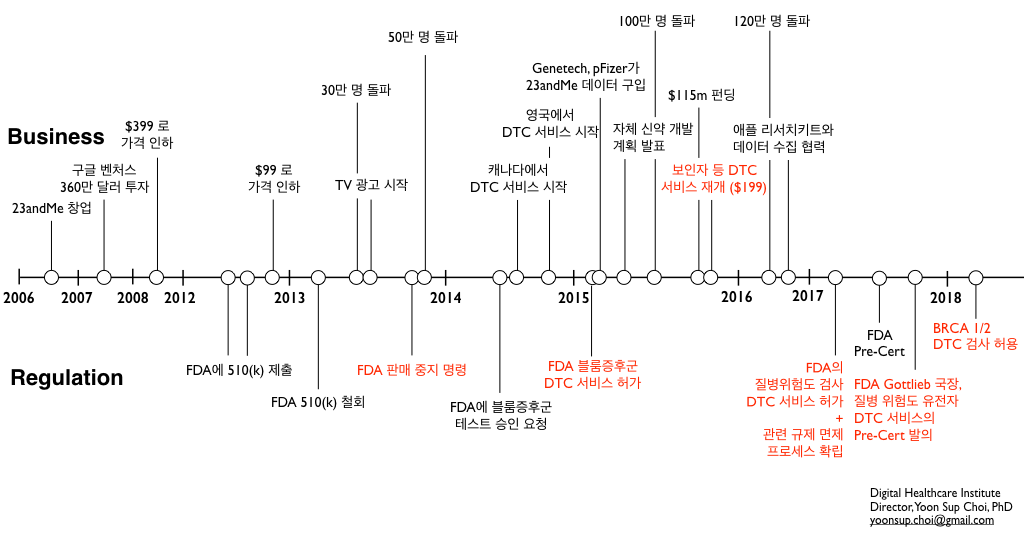
작년 4월 23andMe가 파킨슨, 알츠하이머 등의 10개 질병에 대한 DTC 테스트를 승인 받은 데 이은 1년만의 새로운 소식입니다. 규제와 관련한 온갖 고초를 겪으며 DTC 유전자 분석 서비스 시장을 개척해온 23andMe로서는 또 하나의 새로운 마일스톤을 만들게 되었습니다. 다만, 여기에는 몇 가지 주의해야 할 사항도 포함되어 있습니다.
- 관련 포스팅
최초의 BRCA 유전자 DTC 서비스
‘안젤리나 졸리’ 유전자로 잘 알려진 BRCA 1/2는 유전성 유방암과 난소암의 위험과 관련이 있는 유전자입니다. BRCA에는 수천, 수만 가지 종류의 유전 변이가 존재하며, 이 중 유방암과 난소암 발병 확률을 크게 높이는 위험한 유전 변이는 안젤리나 졸리와 같이 예방적 절제술을 실시하기 위한 근거가 되기도 합니다.
기존에는 의사의 처방이 있어야만 BRCA 유전자 검사를 실시할 수 있었으나, 이번 인허가를 통해서 의사의 처방 없이도, 환자가 집에서 인터넷으로 주문하고 택배로 받아서, 타액을 우편으로 보냄으로써 간편하게 BRCA 검사를 할 수 있게 되었습니다.
다만, DTC 검사에는 항상 환자가 결과를 잘못 해석하는 등의 위험이 있을 수 있다는 우려가 제기됩니다. 이 우려는 2013년 11월 23andMe가 당시까지 제공하던 수백 가지 종류의 질병 위험도, 약물 민감도 등의 분석을 FDA로부터 모두 금지당했던 이유이기도 합니다. 이번에는 (2017년 4월의 DTC 허용 때와 마찬가지로) 환자들이 의사를 통하지 않고 받아보더라도 이 결과를 오해 없이 잘 이해할 수 있으며, 테스트의 한계점 등을 잘 파악한다는 결과를 FDA에 함께 제출하였다고 합니다.
이 테스트는 별도의 검사로 출시되지는 않고, 기존의 23andMe가 제공하던 199불짜리 질병 및 조상 분석에 포함되어서 서비스됩니다. 기존의 23andMe 고객들은 자동으로 이 결과를 받아볼 수 있다고 합니다. (제가 23andMe 홈페이지 들어가서 제 결과를 확인해보니 아직까지는 업데이트가 안 된 것 같긴 합니다)
한계: BRCA의 세 가지 유전 변이만 검사
다만, 이 테스트에는 주의할 점이 있습니다[ref]. 23andMe의 BRCA 1/2 테스트는 단 ‘세 가지’ 종류의 유전 변이의 유무만 검사합니다. 안젤리나 졸리가 했던 Myriad Genetics가 2만여 종류의 변이를 검사하는 것과는 매우 큰 차이입니다. 즉, 23andMe의 테스트에서 ‘변이가 없다’고 나오더라도, 이는 실제로 BRCA의 위험 변이가 (모두) 존재하지 않는다라고 결론을 내리지는 못하는 것입니다.
23andMe가 검사하는 세 종류의 유전 변이는 유럽계인 Ashkenazi Jewish를 조상으로 둔 사람에게서 주로 나타나는 변이입니다. 이 혈통에서 발병하는 유전적 유방암과 난소암 환자의 90%가 이 변이를 가지고 있다고 합니다. 이 변이 중 하나를 가지는 환자는 70세까지 유방암이 발병할 확률이 45-85% 정도가 된다고 합니다.
그런데 문제는 이 세 변이가 Ashkenazi Jewish 혈통이 아닌 환자에 대해서는 그리 많이 발견되지 않는다는 점입니다. 비 Ashkenazi Jewish 혈통의 환자에게서 이 변이가 발견될 확률은 0.1% 이하라고 합니다. 따라서, (위에서 언급했던 것처럼) 이 테스트에서 음성 결과가 나왔다고 해서 유방암과 난소암 위험 변이가 없다는 것을 보장할 수는 없습니다. 이에 FDA는 유방 절제술 등의 의학적 조치를 위해서는 (Myriad Genetics와 같은) 보다 철저하고 광범위한 검사에 기반해야 한다고 강조하고 있습니다.
23andMe가 왜 이렇게 일반 환자에게 많이 발견되지 않는 유전 변이만으로 승인을 받았는지는 여러 해석이 가능할 수 있겠습니다. 특허권 소송 이후에도 여전히 건재한 Myriad Genetics와의 경쟁이나 차별화를 위해서 특정 시장 세그먼트를 타게팅하려 했을 수도 있고, 비교적 근거가 명확한 (이 부분은 확인이 필요합니다) 변이에서 시작했을 수도 있습니다.
향후 전망
23andMe는 2015년에 블룸 증후군 등의 유전질환, 2017년에 알츠하이머 등의 질병에 대한 DTC를 인허가 받은 데 이어, 올해에는 암 유전자의 스크리닝에 대해서도 최초로 포문을 열었습니다. 앞으로도 23andMe는 새로운 암 유전자, 유전 변이를 포함하여 더 많은 질병 위험도 (Genetic Health Risk) 검사에 대해서도 DTC 서비스를 추구할 것으로 예상합니다.
저는 여러번 한국에서의 유전자 분석 DTC 서비스 규제의 불합리성에 대해서 지적한 바 있습니다. 한국에서 DTC는 원천적으로 불법이다가, 2016년 6월 하지 않음만 못한 규제 변화를 통해서 12개의 항목들에 대해서만 DTC를 허용하고 (더구나 검사할 수 있는 유전자 목록까지도 정해져 있습니다), 나머지는 또 여전히 불법으로 규정해놓았습니다.
제가 항상 강조하지만 이 부분은 규제가 과도하다, 완화되었다의 문제가 아니라 규제를 하는 잣대 자체가 국내가 글로벌과 다르다는 것이 문제입니다. 이번 FDA의 인허가로 인해서 안타깝게도 한국의 규제 격차는 또 한 번 더 벌어지게 되었습니다. 앞으로도 이 격차는 더욱 커질 것입니다.
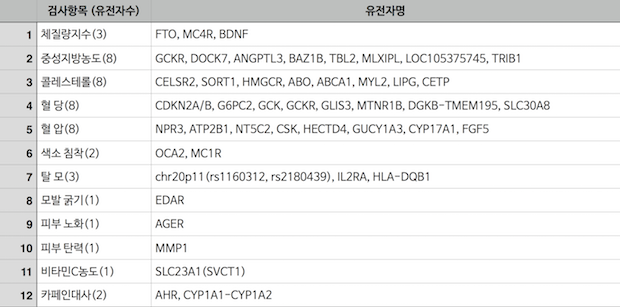 한국에서 DTC 허용된 12가지 항목 및 관련 유전자 목록
한국에서 DTC 허용된 12가지 항목 및 관련 유전자 목록
이번 소식과는 별도로 FDA의 규제 혁신은 더 계속될 것으로도 봅니다. 이번 23andMe의 소식은 DTC 유전자 테스트에 대해서 소위 ‘껀 바이 껀’ 으로 인허가를 내는 기존의 FDA 규제에서 벗어나지 않습니다.
하지만 2017년 7월 FDA가 ‘디지털 헬스 이노베이션 액션 플랜’에서 매우 파격적인 ‘제조사 기반’의 Pre-Cert 프로그램을 제시한 것에 이어서, 2017년 말에는 FDA의 스콧 코틀립 국장이 유전자 테스트에 대해서도 ‘제조사 기반’의 규제를 적용하는 것을 추진하겠다고 언급한 바 있습니다.
이는 ‘한 번이라도’ 질병 위험도 검사에 대해서 DTC의 의료기기 인허가를 받은 기업이라면 (즉, 이 과정을 통해서 유전자 DTC 검사의 정확성, 위해도 등을 충분히 검증받을 수 있는 기업이라면) 그 이후로는 인허가 과정을 ‘면제’ 해주겠다는 것입니다. 당시 이는 아직 ‘안건’의 형태였는데, 저는 올해 이 규제 방안이 새롭게 실현되기를 기대하고 있습니다.

![[논문] LLM이 의료 전문가보다 의학 텍스트 요약을 더 잘 한다](https://www.yoonsupchoi.com/wp-content/uploads/2024/03/Untitled-5-140x90.png)
![[영상] 카카오 브레인의 배웅 최고 헬스케어 책임자(CHO) 님 인터뷰](https://www.yoonsupchoi.com/wp-content/uploads/2024/03/배웅-부사장님-140x90.jpg)
![[공지] DHP 디지털 헬스케어 아카데미 2024 (6기)의 수강생을 모집합니다!](https://www.yoonsupchoi.com/wp-content/uploads/2024/02/홈페이지-메인배너-이미지-copy-140x90.jpg)

















