지난 11월 22일 미국으로부터 놀라운 뉴스가 하나 들려왔습니다. 바로 FDA가 개인 유전정보 검사 기업 23andMe의 DTC (Direct-to-Consumer) 유전자 테스트 키트에 대한 판매를 중지하라는 명령을 내렸다는 것이었습니다. 제가 예전 포스팅에서도 잠깐 소개해드린 적 있는 23andMe는 현재 세계에서 개인 유전자 검사 (Personal Genetic Service, 줄여서 흔히 PGS) 업계를 선도하고 있는, 실리콘 밸리에서도 가장 혁신적인 기업 중의 하나로 손꼽히는 Health-IT 기업입니다. 구글의 창업자 Sergey Brin의 ‘전’ 부인인 Anne Wojcicki 가 공동 창업하였고, 구글벤처스 등의 화려한 투자자들이 재무적으로 뒤를 받치고 있는 것으로도 화제가 되었던 기업이기도 합니다.
Anne Wojcicki가 2006년 공동 창업한 23andMe는 단돈 $99 라는 저렴한 가격에 개인 소비자들로부터 (의사를 거치지 않고) 직접 타액 샘플을 우편으로 받아, 120여개 주요 질병에 대한 위험도, 50여개 유전자들에 대한 유전인자 보유 현황 (carrier status), 20여개 특정 약물에 대한 반응 정도, 60 여개의 유전적인 특징들을 분석해주는 기업입니다.
특히, 23andMe는 개인 유전 정보 분석 시대를 리드하기 위해서, 올해 말까지 1 million 명의 사용자를 확보하겠다는 야심찬 계획을 발표한 바 있습니다. 그리고 (이번 FDA 이슈가 발생하기 전) 최근 Anne Wojcicki의 뉴욕타임즈 인터뷰를 보면 현재는 그 절반 정도인 475,000 명의 데이터를 확보하였으며, 적어도 내년 1분기 까지는 1 million 명이라는 티핑 포인트를 넘을 것으로 예상하고 있었습니다. 또한 최종적으로는 25 million 명의 데이터를 목표로 하고 있다는 뜻도 Fast Company 와의 인터뷰에서 밝힌 바 있습니다.

FDA, 23andMe에 판매 중지 서한을 보내다
FDA는 이러한 개인 유전정보 분석 서비스에 대해서, 지난 11월 22일 Anne Wojcicki에게 보낸 서한에서 FDA의 승인을 받을 때까지 소비자에게 판매를 중지할 것을 명령했습니다. FDA는 국내로 치면 식약청과 같은 정부 기관으로, 새롭게 개발된 약이나 의료 기기들이 환자를 진단 혹은 치료하기 위해서 효과적이면서도 안전한지 여부를 근거로, 그러한 신약/의료기기가 시장에 출시 되어도 될지 여부에 대해 승인을 내리는 역할을 합니다.
중요한 것은 FDA는 오직 ‘약’이나 ‘의료기기’ 와 같은 의료용 목적으로 사용되는 물질/기기만 관장하며, 단순한 헬스케어, 웰니스(wellness) 목적의 제품이나 서비스에 대해서는 관리를 하지 않는다는 것입니다. 그렇다면 과연 23andMe가 제공하는 서비스가 과연 단순한 건강 관리 목적의 서비스인지, 의료용으로도 활용될 수 있는 것인지가 중요한 문제일 것입니다.
사실 23andMe는 창업 초기부터 자신들은 결코 ‘의료용 서비스’나 ‘의료용 진단’ 을 제공하는 것이 아니며, 자신들의 유전정보 분석을 통해 사람들이 더 건강한 삶을 영위할 수 있을 뿐만이 아니라, 자기 스스로에 대해서 더 잘 이해할 수 있다는 것을 강조하였습니다 (아래의 그림 참조).
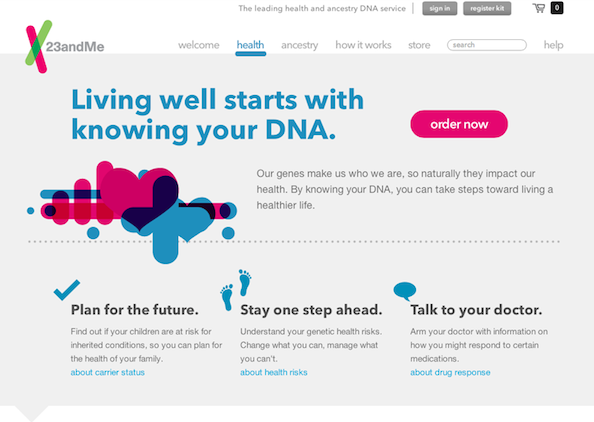
‘living well starts with knowing your DNA’
실제로 이들의 서비스의 결과물들을 보면 다양한 질병에 대한 리스크 정도에 관한 분석도 있지만, 자신의 인종적 뿌리를 찾아주는 ancestry 분석이나, 자신이 유전적으로 술은 얼마나 잘 마실지, 대머리가 될 위험도는 어느 정도인지, 타고난 운동 능력은 어떠한지, 특정 냄새나 맛을 잘 느낄 수 있는지, 내 DNA가 네안데르탈인과 얼마나 유사한지 등 비의료적인 결과와 흥미위주의 결과들을 보여주기도 합니다.
특히 여러 가지 질병의 위험도 분석 결과에 대해서 23andMe는 이 결과들이 결코 의료적으로 확정적인 것이 아니며, 질병의 정확한 진단에 대해서는 전문가와 상담해야 한다는 것을 누누이 강조합니다. 하지만 역시 FDA가 문제를 삼았던 것은 이 질병이나 약물과 관계된 분석이었습니다.
FDA는 이번 서한에서는 ‘안젤리나 졸리 유전자’로 유명해진 BRCA 유전자에 대한 결과나, 유전 형질에 따라 투여 농도가 달라질 수 있는 혈액응고 억제제인 와파린에 대한 분석 결과가 부정확할 경우에 발생할 위험을 직접적인 예로 들고 있습니다.
PGS의 BRCA 관련 질병 리스크나 약물에 대한 반응 결과들은 특히 우려스럽다. 이러한 결과들이 부정확할 경우에 야기될 수 있는 잠재적인 위험 때문이다. 예를 들어, 만약 유방암이나 난소암에 대한 BRCA 분석 결과가 부정확한 경우, 이는 환자들이 불필요한 검사, 수술이나 약물요법 등을 받을 수도 있고, 또 반대로 정말 이러한 처치를 받아야 할 환자가 필수적인 처치를 받지 않게 될 수도 있다
Some of the uses for which PGS is intended are particularly concerning, such as assessments for BRCA-related genetic risk and drug responses … because of the potential health consequences that could result from false positive or false negative assessments for high-risk indications such as these. For instance, if the BRCA-related risk assessment for breast or ovarian cancer reports a false positive, it could lead a patient to undergo prophylactic surgery, chemoprevention, intensive screening, or other morbidity-inducing actions, while a false negative could result in a failure to recognize an actual risk that may exist.
(참고로 위의 원문에 나오는 false positive 는 실제로는 질병의 발병이 위험이 없는데도 검사 결과, 질병의 위험이 ‘높다’고 부정확하게 나온 경우를 말하고, false negative는 실제로는 질병의 발병 위험이 높은데도 검사 결과, 질병의 위험이 ‘낮다’고 부정확하게 나온 경우를 의미합니다.)
결국, FDA는 23andMe의 개인 유전정보 테스트가 결과적으로는 의료용으로 사용될 가능성이 높다고 보고 있고, 이러한 경우 환자에게 발생할지도 모를 위험을 막기 위해서는 반드시 테스트의 정확도에 대한 검증 및 허가를 받아야 한다고 결정한 것입니다.
사실 단순히 이 결과만 보고 안젤리나 졸리처럼 유방 절제술을 받는다든지 (졸리는 의료용으로 FDA 허가를 받은 Myriad Genetics의 BRACAnalysis를 통해서 BRCA 유전자를 검사하여 유방암 위험도를 계산하였습니다. 관련 포스팅) 하는 가능성이 얼마나 될지 의문이기는 하지만, 뉴요커의 기사 등에서는 실제로 이러한 문제가 벌어질 가능성이 낮지 않다고 이야기 하기도 합니다.
 타액 샘플을 우편으로 보내기 위한 23andMe 테스트 키트
타액 샘플을 우편으로 보내기 위한 23andMe 테스트 키트
유전정보 분석에 대해 엄격한 입장을 고수해온 FDA
FDA가 개인 유전정보 분석 서비스 (PGS) 들에 대해서 510(k) 승인을 받아야 한다는 입장을 보여온 것은 비단 어제 오늘의 일만은 아닙니다. 2010년 6월 FDA는 23andMe를 비롯한 deCODE Genetics (2012년 12월 Amgen에 인수), Navigenics (2012년 7월 Life Technology에 인수), Knome, Illumina 등의 5개 유전정보 분석 기업의 테스트가 의료용 기기로 분류될 수 있으므로, 이들의 제품이 시장에서 판매되기 위해서는 FDA 승인을 받아야 한다는 공식 입장을 내어 놓았습니다.
또한, 이에 앞선 2010년 5월 11일 샌디에고에 위치한 개인 유전 정보 분석 기업인 Pathway Genomics 가 자신들의 테스트 키트를 미국의 대형 약국 체인점인 Walgreens에서 오프라인으로 판매하겠다는 계획을 발표하였을 때에도, 바로 이틀 뒤인 13일 FDA는 승인을 받지 않고서는 의료용 서비스를 시장에서 판매할 수 없다는 것을 근거로 오프라인 판매 계획을 중단하라는 공식 입장을 내어 놓은 바 있습니다.
이러한 분야의 선두 기업인 23andMe도 이러한 FDA의 규제에서 결코 자유로울 수 없었을 뿐만 아니라, 당연히 23andMe도 이러한 FDA 승인의 중요성을 숙지하고 있었습니다. 이번 FDA의 서한을 보더라도 23andMe는 2009년 7월부터 FDA와 활발하게 커뮤니케이션 하면서 PGS의 승인을 받기 위하여 협력을 해왔으며, 그로부터 3년 뒤인 2012년 7월 2일과 9월 4일 두 차례에 걸쳐 510(k) 승인을 받기 위한 요청(submission)을 진행하였다는 것을 알 수 있습니다.

이번 FDA의 서한에는 어떤 내용이 담겨 있나
이렇게 오랜 기간 23andMe와 FDA가 협력하는 과정에서 FDA 측에서도 상당한 노력과 시간을 할애한 것으로 보입니다. 이번 FDA가 보낸 서한에는 자신들이 그 동안 많은 노력을 기울였다는 점을 이례적으로 상세하게 설명하고 있습니다.
우리는 23andMe와 협력하면서 14번의 얼굴을 맞댄 원격회의와, 수백통의 이메일 교환과, 열번이 넘는 서한을 포함한 구체적인 피드백을 의학적/분석적인 검증을 위하여 보내었으며, 규제를 받기 위한 시한, 승인 분류등을 논하였을 뿐만 아니라, 통계적인 조언, 잠재적인 리스크를 회피할 수 있는 방안 까지 알려주었다.
As part of our interactions with you, including more than 14 face-to-face and teleconference meetings, hundreds of email exchanges, and dozens of written communications, we provided you with specific feedback on study protocols and clinical and analytical validation requirements, discussed potential classifications and regulatory pathways (including reasonable submission timelines), provided statistical advice, and discussed potential risk mitigation strategies.
하지만 23andMe는 FDA의 이러한 요구에 대하여 최근까지도 충분한 근거 자료나 검증 결과를 내어 놓지 못하였고, 또한 최근에는 무슨 이유에서인지 FDA에 상당히 협조적이지 않았던 것으로 보입니다. 이러한 것들이 결국 이번 판매 금지에 영향을 미치지 않았나 합니다. 이러한 것들에 대한 상황 설명이 이번 서한에서 다소 의아하게 여겨질 정도로 자세하게 설명이 되고 있습니다.
귀사에서 2013년 1월 9일에 보낸 서한에는 ‘테스트에 대한 추가적인 분석/의료적인 검증이 완료되고 있는 중’이며, ‘완료까지 몇개월이 더 걸릴 예정인 대규모 검증을 계획하고 있다’라고 되어 있다. 하지만 그 몇 개월이 지났으며, 더구나 그 상품을 판매하기 시작한지 5년이 지난 지금까지도, 당신들은 PGS의 판매 승인을 받기 위한 연구를 완료하지 못했으며, 어떤 부분들은 아예 시작도 하지 않았다.
11개월이 지난 지금도 당신들은 FDA에 아무런 새로운 정보를 제공하지 못하고 있다. 승인에 관한 새로운 분류 작업도 함께 수행하지 않았으며, 510(k) 승인 리뷰를 위한 추가적인 정보도 제공하지 않았을 뿐만 아니라, 지난 5월 이후로 FDA는 23andMe로부터 아예 아무런 연락도 받지 못했다.
In your letter dated January 9, 2013, you stated that the firm is “completing the additional analytical and clinical validations for the tests that have been submitted” and is “planning extensive labeling studies that will take several months to complete.” Thus, months after you submitted your 510(k)s and more than 5 years after you began marketing, you still had not completed some of the studies and had not even started other studies necessary to support a marketing submission for the PGS.
It is now eleven months later, and you have yet to provide FDA with any new information about these tests. You have not worked with us toward de novo classification, did not provide the additional information we requested necessary to complete review of your 510(k)s, and FDA has not received any communication from 23andMe since May.
또한, FDA는 서한에서 23andMe가 지난 8월 시작한 대규모 텔레비젼 광고까지 직접적으로 언급하고 있습니다. FDA의 승인을 받지 않았고, 승인을 받기 위한 관련 자료도 여전히 제출하지 않고 있음에도 불구하고, 대규모 텔레비젼 프로모션을 한 것이 FDA의 심기를 결정적으로 건드린 것이 아닐까 하는 것을 엿볼 수 있는 부분입니다.
(서류를 제출하는) 대신에, 우리는 당신들이 텔레비젼 광고를 포함한 새로운 마케팅을 시작하였으며, 분석하는 질병의 개수를 더욱 늘렸다는 것을 알게 되었다. 이는 PGS에 대한 소비자 층을 FDA의 판매 승인 없이 더욱 확장하고자 하는 계획을 보여주고 있다.
Instead, we have become aware that you have initiated new marketing campaigns, including television commercials that, together with an increasing list of indications, show that you plan to expand the PGS’s uses and consumer base without obtaining marketing authorization from FDA.
아래의 동영상이 바로 그 문제의 텔레비젼 광고입니다. ‘This is Me’를 외치는 이 광고에서, 23andMe는 소비자들이 자신의 유전정보를 이해함으로써 자기 자신을 더욱 잘 알 수 있다는 것을 강조하고 있습니다. (‘The more you know about your DNA, the more you know about yourself’) 뿐만 아니라, 심장병, 관절염 등의 질병에 대한 위험도, 자신에게 맞는 음 식 등을 알게 됨으로써 더욱 건강한 삶을 영위할 수 있다는 메시지를 줍니다. FDA의 입장에서는 이 질병에 대한 분석이 자신들의 승인을 받지 않았다는 것이 문제였던 것이지요.
FDA 앞에 넙죽 엎드린 23andMe
23andMe는 FDA로부터 이런 서한을 받은 직후 아래와 같은 짧지만 명확한 공식 입장을 내어 놓았습니다. FDA에 최대한 협조를 하겠다는 내용이었습니다. 규제 기관인 FDA가 수퍼 갑인 만큼 당연한 반응이라고도 볼 수 있을 것 같습니다.
우리는 우리가 시간적으로나 의사소통에 관해서 FDA의 요구를 제대로 충족시키지 못했다는 것을 알게 되었다. FDA와 우리의 관계는 매우 중요하며, 그들의 우려를 최대한 해소할 수 있도록 전적으로 노력하겠다.
We recognize that we have not met the FDA’s expectations regarding timeline and communication regarding our submission. Our relationship with the FDA is extremely important to us and we are committed to fully engaging with them to address their concerns.
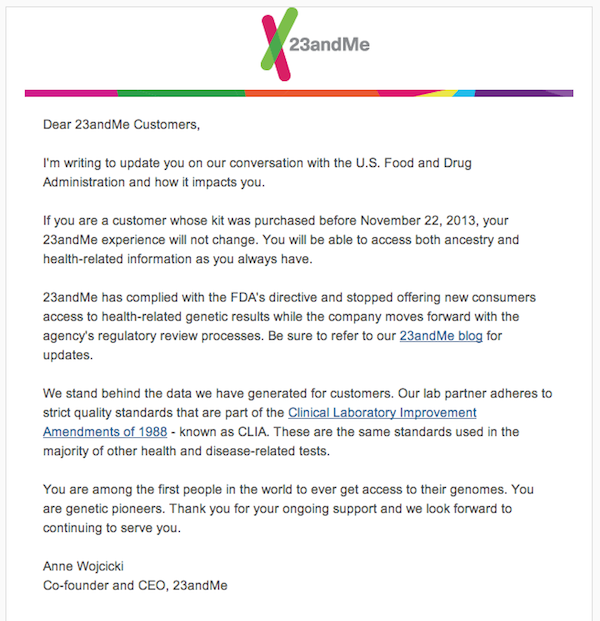
그리고 지난 12월 7일 Anne Wojcicki 가 직접 23andMe 고객들에게 아래와 같은 메일을 보냈습니다. 11월 22일 이전에 서비스를 신청한 고객들에게는 예전과 같이 질병 분석을 포함한 전체 분석 결과를 제공하겠지만, 11월 22일 이후에 서비스를 신청한 사람들에게는 ancestry 분석만 제공하겠다는 것입니다.
23andMe가 왜 FDA에 비협조적이 되었을까
그런데 올해 초까지만 해도 FDA에 협조적이던 23andMe가 갑자기 왜 이렇게 FDA에 대해서 비협조적이 되었고, 그들의 심기를 건드렸을지 의아한 생각이 들지 않을 수 없습니다. 이에 관해서, 뉴요커의 기사는 두 가지 추측을 내어 놓습니다.
첫번째 추측은 23andMe가 FDA와 의도적으로 자극하려고 했다는 것이지만 가능성은 높지 않을 것으로 보고 있으며, 두번째 가능성은 정말로 단순히 실수를 했다 (simply dropped the ball)는 것입니다. 기사에서도 인정하듯이 두 설명 모두 그리 설득력이 있어 보이지는 않지만, 별다른 다른 설명도 가능할 것 같지는 않습니다.
Anne Wojcicki 와 함께 2006년 23andMe를 공동 창업했다가, 2009년 회사를 떠난 Linda Avey는 FDA와 23andMe 사이에 무슨 일이 있었는지 모르겠다면서, 그 동안 23andMe에서 FDA와의 협상을 이끌던 법률 담당자 (general counsel)가 올 여름 회사를 떠난 것이 이러한 실수로 이어졌을 수도 있다는 의견을 내어 놓기도 하였습니다. 아래는 Linda Avey 의 말을 그대로 옮긴 것입니다.
“내가 거기에 일할 당시에는 우리는 FDA에 매우 협조적이었다. 지금도 그러한 문화는 그때와 크게 다르지 않을 것으로 생각한다. 아마도 충분한 주의를 기울이지 않았기 때문이 아닐까 한다.”
“The whole time I was there,” Avey told me on the phone yesterday, “we were in an outreach mode with the F.D.A. I can’t imagine there was that much of a cultural shift since then. It might be they weren’t paying close attention.”
또한 12월 10일 뉴욕타임즈에 보도된 기사에 따르면 Anne Wojcicki는 최근 “23andMe는 너무 느리게 움직였고, FDA와 의사소통하는 것에 문제가 있었다 (23andMe moved too slowly and failed to communicate with regulators)” 라고도 인정을 하였습니다.
뿐만 아니라, 같은 기사에서 그녀는 “23andMe는 너무도 새로운 서비스이기 때문에, 기존의 FDA가 가진 시스템에 들어 맞지 않는다. 마치 둥근 구멍에 네모난 말뚝을 박으려는 것과 같다 (The service the company provides is so novel that it does not fit into the F.D.A.’s framework, like “a square peg in a round hole”)” 고 하면서 FDA 시스템에 대한 다소간의 불만을 드러내기도 하였습니다.
 a square peg in a round hole
a square peg in a round hole
의료 보험사의 압력과 모종의 관계설
또 한 가지 흥미로운 분석은, 이번 규제가 미국의 의료 보험사들과도 관계가 있을 수 있다는 것입니다. ‘왜 23andMe가 의료보험사를 위협했나 (Why 23andMe Terrifies Health Insurance Companies)’는 제목의 이 Fast Company의 분석에서는, 특정 질병에 대한 위험도가 높게 나온 고객이 아직 그 질병에 걸리지 않았음에도 여러 의학적인 검사를 받게 된다면 그 검사비에 대한 의료 보험료 지급 때문에 보험사의 부담이 높아질 것이라고 이야기 합니다.
또한, 자신들의 질병 발병 확률을 알고 있는 고객들이 위험한 질병에 대해서는 의료 보험을 많이 들고, 발병 확률이 낮은 질병은 보험을 들지 않을 수도 있다는 것입니다. 보험 가입자 중 보험금을 타가는 고객이 많아질수록 보험사의 수익은 낮아질 수 밖에 없습니다. 이런 측면에서 볼 때, 고객들에게 발병 확률을 알려주는 23andMe의 서비스는 의료 보험사에게 정말 눈엣가시였을 수도 있겠다는 생각이 듭니다.
흔히 개인 유전정보의 분석의 큰 위험으로 항상 언급되는 것 중의 하나가, 개인 유전 정보를 보험사가 가졌을 경우 보험 가입자에 대한 차별입니다. 예를 들어, 암 발병 확률이 높은 사람은 암 보험에 가입시켜주지 않는 것이지요. 하지만 반대로 그 정보를 각 개인들이 가지고 있을 경우는 정반대의 결과가 나타날 수도 있다는 것입니다.
이번 FDA의 규제에 대한 업계에서의 반응
이러한 FDA의 제제에 대해서 관련 업계에서는 적절하다는 주장과 너무 지나쳤다는 상반된 주장이 동시에 나오고 있습니다.
개인에게 직접 판매하는 유전자 테스트에 대해서 회의적인 입장을 보이는 쪽에서는 이러한 규제에 대해서 찬성하고 있습니다. University of North Carolina School of Medicine의 의학 유전학자 James Evans 는 “사람들이 교묘한 광고에 속아서 의학적인 정밀 진단을 받는 일이 있어서는 안 된다 ( People shouldn’t be taking complex medical tests because they were seduced by clever ads)” 라고 언급하기도 하였습니다.
반대로, 개인 유전자 테스트를 찬성하는 쪽에서는 23andMe 테스트의 위험도를 FDA가 너무 과장하고 있다면서 반대의 입장을 보이고 있습니다. Duke University의 유전체 정책 분석가인 Misha Angrist 는 여성들이 단순히 23andMe의 결과만으로 유방을 절제하거나 난소를 적출하는 일은 없을 것이라고 언급했습니다. 또한 이번 규제가 너무 과도하다며, ‘해머로 모기를 불필요하게 죽이는 격 (It just seems like a gratuitous killing of a mosquito with a sledgehammer)’ 이라고도 하였습니다.

23andMe는 이 규제에 어떻게 대처할까
일단 23andMe는 FDA의 판매 중지 명령을 따라, 질병 분석에 관한 서비스를 중단한 상태이며 FDA가 요구하는 검사 결과의 정확성 검증 및 의료 기기 승인 절차에 최대한 협조할 것으로 보입니다. 하지만 이 검증 절차가 생각만큼 간단해 보이지는 않는다는 것이 문제입니다.
그 속성상, 법이나 규제는 첨단 기술의 눈부신 발전 속도를 따라올 수 없고, 항상 뒤늦게 따라올 수 밖에 없습니다. FDA의 규제도예외는 아니어서, 특히 Health-IT 분야에서 뒷북(?)을 치면서 여러 원성을 듣기도 합니다. 헬스케어 어플리케이션에 대한 가이드라인을 몇년 만에 내어 놓은 것도 그러하였고, 이번 23andMe의 경우도 그 대표적인 예라고 할 수 있습니다.
문제는 Wojcicki가 지적하였듯이, 개별적인 유전자 테스트를 각각 승인하도록 되어 있는 현재 FDA 승인 시스템 하에서 23andMe와 같이 수천, 수만개의 유전자 (더 정확히는 SNP)를 한번에 검사하는 이 새로운 방법에 대해서는 어떻게 승인 여부를 결정할 것인가 하는 것입니다.
the F.D.A.’s approval system is set up to approve individual tests, but 23andMe tests about a million components of a person’s DNA. Filing for a million approvals would be impossible.
뉴요커의 기사가 지적하듯, 정말로 FDA가 23andMe가 제공하는 모든 종류의 분석 값에 대한 검증을 요구한다면, 아마도 앞으로 이러한 종합적인 유전자 테스트를 값싼 가격에 제공할 수 있는 기업은 없게 될지도 모릅니다. University of North Carolina in Chapel Hill의 기술법 (technology law) 전문가인 John Conley는 ‘그렇지 않아도 고전하고 있는 소비자 유전자 테스트 회사들을 더욱 어렵게 하는 것 (the agency’s move against 23andMe could further discourage companies from entering the already struggling direct-to-consumer genomics market)’ 이라고 지적하였습니다.
앞서 언급하였다시피, 2010년 이후 FDA는 유전자 테스트 업체에 이러한 ‘의료용 기기’를 승인 받아야 한다고 지속적으로 규제 하였고, 이에 따라 deCODE Genetics 나, Navigenics 와 같은 업계의 유명 선도 기업들이 결국 사업 모델을 바꾸거나, 다른 기업에 인수 당해서 유명무실 해지는 등의 변화를 겪었지요.
23andMe도 이러한 다른 업체들의 전철을 밟지 않으리라는 보장은 없습니다. 하지만, 기존의 23andMe는 이러한 이슈에 부딛혀서 해결할 수 있으며 지금껏 보여 온 여러 혁신적이고 선구자적인 행보 때문에 문제를 잘 해결할 것이라는 기대를 갖게 합니다. 재정적으로 구글 벤처스의 든든한 후원을 받고 있다는 점. Anne Wojcicki 라는 세계에서 가장 주목받고 발언권 있는 여성 CEO를 가지고 있다는 것. 그리고 무엇보다 이미 500,000명에 육박하는 사용자 데이터를 축적한 상태라는 것이 바로 그러한 강점들 입니다.

이번 규제의 결과는 향후 유전체 의학에 큰 영향을 미칠 것
더 나아가, 이번에 23andMe가 FDA의 규제에 대처해나가는 방식과 이 결과로 제정될 규제 가이드라인은 향후 DTC 유전 정보 테스트 뿐만이 아니라, 유전체 분석 기반의 맞춤 의료의 구현에도 큰 영향을 미칠 것입니다. NGS 기반의 유전체 분석 (whole genome sequencing)이나 엑솜 분석 (whole exome sequencing)을 통해서 유전자 변이 기반으로 환자의 진단을 내리는 것이 제도권 의료 시스템으로 편입되기 위해서는 이와 비슷한 과정을 거쳐야 할 것입니다.
유전체 의학이 발전이 거스를 수 없는 도도한 역사의 흐름이라는 것을 누구도 부인하고 있지는 않지만, 또한 현재 FDA의 ‘개별 유전자’ 승인 시스템으로는 이를 검증할 마땅한 방법이 없는 것도 사실입니다.
점차 눈 앞으로 다가오는 개인 유전자 분석의 시대, 유전체 의학의 시대에 이러한 이런 진통은 언젠가는 한번 겪어야 할 것이라는 점을 23andMe와 FDA, 그리고 관련 업계 사람들은 모두 인지하고 있습니다. 이번 기회에 현명한 승인 가이드라인이 제정되어, 생명 과학과 의학 기술의 눈부신 발전에 따른 성과를 일반 사람들과 환자들이 하루 빨리 영위할 수 있게 되기를 바랍니다.


![[논문] LLM이 의료 전문가보다 의학 텍스트 요약을 더 잘 한다](https://www.yoonsupchoi.com/wp-content/uploads/2024/03/Untitled-8-140x90.png)
![[영상] 카카오 브레인의 배웅 최고 헬스케어 책임자(CHO) 님 인터뷰](https://www.yoonsupchoi.com/wp-content/uploads/2024/03/배웅-부사장님-140x90.jpg)

![[영상] 루닛 백승욱 의장님 인터뷰](https://www.yoonsupchoi.com/wp-content/uploads/2024/01/썸네일-종합.219-140x90.jpeg)

















1 Comment